Video
Prospecto
Prospecto: información para el usuario
Terrosa 20 microgramos/80 microlitros solución inyectable en pluma precargada
teriparatida
Lea todo el prospecto detenidamente antes de empezar a usar este medicamento, porque contiene información importante para usted.
- Conserve este prospecto, ya que puede tener que volver a leerlo.
- Si tiene alguna duda, consulte a su médico o farmacéutico.
- Este medicamento se le ha recetado solamente a usted, y no debe dárselo a otras personas aunque tengan los mismos síntomas que usted, ya que puede perjudicarles.
- Si experimenta efectos adversos, consulte a su médico o farmacéutico, incluso si se trata de efectos adversos que no aparecen en este prospecto. Ver sección 4.
Contenido del prospecto
- Qué es Terrosa y para qué se utiliza
- Qué necesita saber antes de empezar a usar Terrosa
- Cómo usar Terrosa
- Posibles efectos adversos
- Conservación de Terrosa
- Contenido del envase e información adicional
1. Qué es Terrosa y para qué se utiliza
Terrosa contiene el principio activo teriparatida, que es empleado para aumentar la fortaleza del hueso y reducir el riesgo de fracturas mediante la estimulación de la formación de hueso.
Terrosa se usa para el tratamiento de la osteoporosis en adultos. La osteoporosis es una enfermedad que hace que sus huesos se desgasten y se vuelvan frágiles. Esta enfermedad es especialmente frecuente en las mujeres después de la menopausia, pero también puede ocurrir en varones. La osteoporosis también es frecuente en pacientes tratados con medicamentos denominados corticosteroides.
2. Qué necesita saber antes de empezar a usar Terrosa
No use Terrosa
- si es alérgico a teriparatida o a alguno de los demás componentes de este medicamento (incluidos en la sección 6).
- si tiene niveles de calcio elevados en la sangre (hipercalcemia preexistente).
- si padece problemas graves de riñón.
- si alguna vez ha tenido cáncer de huesos o si otros tipos de cáncer se han extendido (metastatizado) a sus huesos.
- si tiene determinadas enfermedades de los huesos. Si tiene una enfermedad de los huesos consulte a su médico.
- si tiene niveles elevados de fosfatasa alcalina en sangre sin explicación aparente, lo cual podría indicar que padece la enfermedad de Paget en el hueso (enfermedad con cambios anormales del hueso). Si no está seguro, consulte a su médico.
- si ha recibido radioterapia que haya podido afectar a sus huesos.
- si está embarazada o en la lactancia.
Advertencias y precauciones
Terrosa puede aumentar el calcio en su sangre u orina.
Consulte a su médico antes o mientras esté utilizando Terrosa:
- Si usted tiene continuamente náuseas, vómitos, estreñimiento, baja energía o debilidad muscular dígaselo a su médico. Estos pueden ser síntomas de que hay demasiado calcio en su sangre.
- Si usted sufre de piedras en el riñón o ha tenido piedras en el riñón.
- Si usted sufre de problemas de riñón (insuficiencia renal moderada).
Algunos pacientes, tras las primeras dosis de Terrosa, sufren mareos o aumento de la frecuencia cardiaca. Para las primeras dosis, utilice Terrosa en un lugar donde pueda sentarse o tumbarse inmediatamente si se marea.
El tiempo de tratamiento recomendado de 24 meses no debe ser excedido.
Antes de empezar a utilizar una nueva pluma precargada, anote el número de lote (Lote) del medicamento y la fecha de la primera inyección en la caja de la pluma precargada y en un calendario y proporcione esta información cuando comunique cualquier reacción adversa.
Terrosa no debe utilizarse en adultos en crecimiento.
Niños y adolescentes
Terrosa no debe utilizarse en niños y adolescentes (menores de 18 años).
Otros medicamentos y Terrosa
Informe a su médico o farmacéutico si está utilizando, ha utilizado recientemente o pudiera tener que utilizar cualquier otro medicamento.
Esto es importante porque algunos medicamentos (p. ej., digoxina/digitálicos, un medicamento empleado para tratar enfermedades cardiacas) pueden interactuar con teriparatida.
Embarazo y lactancia
No utilice Terrosa si está embarazada o en periodo de lactancia. Si usted es una mujer en edad fértil, debe utilizar métodos anticonceptivos eficaces durante el tratamiento con Terrosa. Si se queda embarazada mientras está utilizando Terrosa, debe interrumpirse el tratamiento con Terrosa. Consulte a su médico o farmacéutico antes de utilizar este medicamento.
Conducción y uso de máquinas
Algunos pacientes pueden sentir mareos después de la inyección de Terrosa. Si usted siente mareo no debe conducir o usar máquinas hasta que se encuentre mejor.
Terrosa contiene sodio
Este medicamento contiene menos de 1 mmol de sodio (23 mg) por unidad de dosis; esto es, esencialmente “exento de sodio”.
3. Cómo usar Terrosa
Siga exactamente las instrucciones de administración de este medicamento indicadas por su médico. En caso de duda, consulte de nuevo a su médico o farmacéutico.
La dosis recomendada es de 20 microgramos (correspondientes a 80 microlitros) administrados una vez al día mediante una inyección debajo de la piel (inyección subcutánea) en el muslo o en el abdomen.
Para ayudarle a recordar inyectarse su medicamento, inyéctese sobre la misma hora cada día. Terrosa puede inyectarse a la hora de las comidas.
Inyéctese Terrosa cada día durante tanto tiempo como su médico se lo prescriba. La duración total del tratamiento con Terrosa no debe exceder 24 meses. Usted no debe recibir más de un ciclo de 24 meses de tratamiento a lo largo de su vida.
Su médico puede aconsejarle que use Terrosa con calcio y vitamina D. Su médico le indicará qué cantidad debe tomar cada día.
Terrosa puede administrarse con o sin comida.
Las agujas de inyección compatibles no se suministran con Terrosa.
La pluma precargada puede utilizarse con agujas de inyección desarrolladas según la norma ISO de agujas de pluma de un calibre entre 29 G y 31 G (diámetro de 0,25 – 0,33 mm) y una longitud entre 5 mm y 12,7 mm sólo para la inyección subcutánea.
Para el uso correcto de este medicamento, es muy importante seguir de estrictamente las instrucciones de uso detalladas de la pluma precargada que se proporcionan con el medicamento.
Use una nueva aguja de inyección para cada inyección a fin de prevenir la contaminación y deseche de forma segura la aguja después de su utilización.
Nunca guarde la pluma con la aguja colocada.
No transfiera el medicameno a una jeringa.
Debe inyectar Terrosa poco tiempo después de haber sacado la pluma precargada de la nevera. Coloque el capuchón de la pluma en la pluma precargada y vuelva a poner la pluma en la nevera inmediatamente después de su uso. Consérvelo en la nevera antes y durante el periodo de tratamiento completo de 28 días.
Preparación para la inyección
- Para garantizar la correcta administración de Terrosa lea siempre las Instrucciones de uso de la pluma precargada Terrosa, incluidas en el estuche del medicamento.
- Lávese las manos antes de manipular la pluma precargada.
- Compruebe la fecha de caducidad en la etiqueta de la pluma precargada antes de empezar a utilizar el medicamento. Asegúrese de que falten al menos 28 días hasta la fecha de caducidad. Anote el número de lote (Lote) y la fecha de la primera inyección de la pluma precargada en uso en un calendario. También debe apuntarse la fecha de la primera inyección en el estuche de Terrosa (ver el espacio provisto en la caja: {Primera utilización:}).
- Coloque una aguja de inyección nueva en la pluma precargada y establezca la dosis en la ventana de visualización girando el botón de ajuste de dosis.
Inyección de Terrosa
- Antes de inyectar Terrosa, limpie la piel donde piensa inyectarla (muslo o abdomen) como se lo haya indicado el médico.
- Pellizque con suavidad la piel que ha limpiado e inserte la aguja de forma perpendicular a la piel. Presione el botón de ajuste de dosis y manténgalo presionado al menos durante 6 segundos para asegurarse que recibe la dosis completa.
- En cuanto haya finalizado la inyección, coloque el capuchón de protección de la aguja en la aguja de la pluma; enrosque el capuchón en sentido contrario al de las agujas del reloj para retirar la aguja de la pluma. Esto mantendrá la esterilidad del Terrosa restante y evitará fugas de la pluma. También evitará que entre de nuevo aire en la pluma precargada y que la aguja se obstruya.
- Vuelva a colocar el capuchón en la pluma.
- Deseche las agujas de las plumas de forma segura utilizando un recipiente para objetos punzocortantes o siguiendo las indicaciones de su médico
Si usa más Terrosa del que debe
Si por error se ha administrado más cantidad de Terrosa de la prescrita, consulte a su médico o farmacéutico.
Los efectos que pueden esperarse de una sobredosis incluyen náuseas, vómitos, mareos y dolor de cabeza.
Si olvidó usar Terrosa
Si olvida una inyección o no puede inyectarse su medicamento a la hora habitual, hágalo tan pronto como pueda ese mismo día. No use una dosis doble para compensar las dosis olvidadas. No se inyecte más de una vez en el mismo día.
Si interrumpe el tratamiento con Terrosa
Si está pensando interrumpir el tratamiento con Terrosa, por favor consulte con su médico. Su médico le aconsejará y decidirá sobre cuánto tiempo debe ser tratado con Terrosa. Si tiene cualquier otra duda sobre el uso de este medicamento, pregunte a su médico o farmacéutico.
4. Posibles efectos adversos
Al igual que todos los medicamentos, este medicamento puede producir efectos adversos, aunque no todas las personas los sufran.
Los efectos adversos más frecuentes son dolor en las extremidades (muy frecuentes, pueden afectar a más de 1 de cada 10 pacientes). Otros efectos adversos frecuentes (que afectan a hasta 1 de cada 10 pacientes) son malestar, dolor de cabeza y mareo. Si se marea después de una inyección, siéntese o túmbese hasta que se encuentre mejor. En caso de no mejorar, consulte a su médico antes de continuar con el tratamiento. Ha habido casos de desmayo tras el uso de teriparatida.
Si tiene molestias alrededor de la zona de inyección como enrojecimiento de la piel, dolor, hinchazón, picor, hematomas o ligero sangrado (que pueden ocurrir frecuentemente), éstas deberían desaparecer en unos días o semanas. Si no es así, dígaselo a su médico.
Raras (pueden afectar hasta 1 de cada 1 000 pacientes), algunos pacientes pueden experimentar reacciones alérgicas, que consisten en dificultad para respirar, hinchazón de la cara, erupción cutánea y dolor en el pecho. Normalmente estas reacciones tienen lugar justo después de la inyección. En raras ocasiones, pueden producirse reacciones alérgicas graves y potencialmente mortales, incluyendo anafilaxia.
Otros efectos adversos son:
Frecuentes (pueden afectar hasta 1 de cada 10 pacientes):
- aumento de los niveles de colesterol en sangre
- depresión
- dolor neuropático en la pierna
- sensación de desvanecimiento
- sensación de que todo da vueltas
- palpitaciones irregulares
- dificultad para respirar
- aumento de la sudoración
- calambres musculares
- pérdida de energía
- cansancio
- dolor de pecho
- tensión arterial baja
- acidez de estómago (dolor o sensación de ardor justo debajo del esternón)
- vómitos
- hernia del tubo que lleva la comida hasta su estómago (hernia de hiato)
- hemoglobina baja o bajo recuento de glóbulos rojos (anemia)
Poco frecuentes (pueden afectar hasta 1 de cada 100 pacientes):
- aumento de la frecuencia cardiaca
- sonido anormal del corazón
- falta de aliento
- almorranas (hemorroides)
- pérdida de orina
- aumento de la necesidad de orinar
- aumento de peso
- piedras en el riñón
- dolor en los músculos y en las articulaciones. Algunos pacientes han tenido calambres en la espalda graves o dolor y tuvieron que ingresar en el hospital.
- aumento en los niveles de calcio en sangre
- aumento de los niveles de ácido úrico en sangre
- aumento en los niveles de una enzima llamada fosfatasa alcalina
Raros (pueden afectar hasta 1 de cada 1 000 pacientes):
- reducción de la función del riñón, incluyendo insuficiencia renal
- hinchazón, principalmente en las manos, pies y piernas
Comunicación de efectos adversos
Si experimenta cualquier tipo de efecto adverso, consulte a su médico o farmacéutico, incluso si se trata de posibles efectos adversos que no aparecen en este prospecto. También puede comunicarlos directamente a través del sistema nacional de notificación incluido en el Apéndice V. Mediante la comunicación de efectos adversos usted puede contribuir a proporcionar más información sobre la seguridad de este medicamento.
5. Conservación de Terrosa
Mantener este medicamento fuera de la vista y del alcance de los niños.
No utilice este medicamento después de la fecha de caducidad que aparece en el envase y en la pluma precargada después de CAD y EXP respectivamente. La fecha de caducidad es el último día del mes que se indica.
Conservar en nevera (entre 2 °C y 8 °C). La pluma precargada debe volver a ponerse en la nevera inmediatamente después de su uso. No congelar.
Mantener el capuchón de la pluma colocado en la pluma precargada para protegerlo de la luz.
Puede utilizar Terrosa durante 28 días después de la primera inyección mientras la pluma precargada se conserve en nevera (entre 2 ºC y 8 ºC).
Evite colocar la pluma precargada cerca del congelador de la nevera para prevenir su congelación. No use Terrosa si está o ha estado congelado.
Cada pluma precargada debe desecharse de forma adecuada después de 28 días del primer uso, aunque no esté vacío del todo.
Terrosa contiene una solución transparente e incolora. No utilice Terrosa si tiene partículas sólidas o si la solución está turbia o presenta color.
Los medicamentos no se deben tirar por los desagües ni a la basura. Pregunte a su farmacéutico cómo deshacerse de los envases y de los medicamentos que ya no necesita. De esta forma, ayudará a proteger el medio ambiente.
6. Contenido del envase e información adicional
Composición de Terrosa
- El principio activo es teriparatida. Cada dosis de 80 microlitros contiene 20 microgramos de teriparatida. Un pluma precargada de 2,4 ml contiene 600 microgramos de teriparatida (correspondientes a 250 microgramos por ml).
- Los demás componentes son: ácido acético glacial, manitol, metacresol, acetato de sodio trihidrato, ácido clorhídrico (para ajustar el pH), hidróxido de sodio (para ajustar el pH) y agua para preparaciones inyectables (ver sección 2 “Terrosa contiene sodio”).
Aspecto del producto y contenido del envase
Terrosa es una solución inyectable (inyectable) transparente e incolora. Se presenta en una pluma precargada. Cada pluma precargada contiene 2,4 ml de solución suficiente para 28 dosis.
Tamaños de envase: cajas conteniendo 1 o 3 plumas precargadas.
Puede que solamente estén comercializados algunos tamaños de envases.
Titular de la autorización de comercialización y responsable de la fabricación
Gedeon Richter Plc.
Gyömrői út 19-21.
1103 Budapest
Hungría
Fecha de la última revisión de este prospecto:
Otras fuentes de información La información detallada de este producto está también disponible escaneando el código QR que figura a continuación o el estuche con un smartphone. La misma información también está disponible en la siguiente URL: www.terrosapatient.com

La información detallada de este medicamento está disponible en la página web de la Agencia Europea de Medicamentos: http://www.ema.europa.eu
Instrucciones de uso
Terrosa 20 microgramos(µg)/80 microlitros solución inyectable en pluma precargada
Instrucciones de Uso
Información importante
Esta pluma precargada Terrosa es para la administración diaria de una dosis fijada de 80 microlitors de la solución para inyección Terrosa para el tratamiento de la osteoporosis.
Su pluma precargada contiene 28 dosis.
No hay posibilidad de establecer otra dosis distinta a 80 microlitros.
Si no puede esblecer la dosis de 80 microlitros es porque su pluma está casi vacía.
La pluma de Terrosa Pen no es recargable, no la utilice después de administrar 28 dosis.
Partes de la pluma
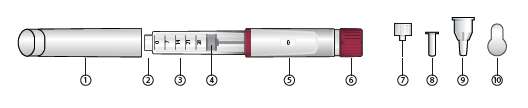
1. Capuchón de la pluma
2. Conector de la aguja
3. Portacartuchos
4. Émbolo del cartucho
5. Visor/pantalla
6. Botón de ajuste de dosis
7. Aguja de la pluma
8. Capuchón interno de la aguja
9. Capuchón externo de la aguja
10. Lámina despegable
La aguja de la pluma no se suministra junto a la pluma. Debe estar colocada antes de utilizar la pluma (ver paso 1c).
Antes de empezar
Antes de empezar a utilizar una nueva pluma, por favor, lea completamente estas instrucciones. Siga las directrices cuidadosamente cuando use la pluma. Lea también el prospecto.
Anote la fecha de la primera inyección en un calendario.
No comparta su pluma o sus agujas ya que puede correr el riesgo de transmitir agentes infecciosos.
Lávese las manos antes de cada inyección.
No utilice su pluma Terrosa si está dañada o si tiene alguna duda sobre su correcto funcionamiento.
Prepare todo lo que va a necesitar:
• torunda impregnada en alcohol
• la pluma precargada
• la aguja de la pluma
1. Preparación de la pluma
1/a Retire el capuchón de la pluma
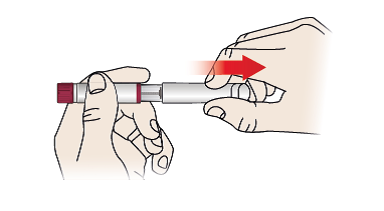
- Retire el capuchón de la pluma (1) tirando de él.
1/b Compruebe el medicamento
- Compruebe la etiqueta de la pluma para asegurarse de que tiene el medicamento correcto y de que no está caducado.
- No use la pluma Terrosa si:
- la pluma está dañada.
- la solución está turbia, coloreada o contiene partículas.
1/c Ajuste la aguaja
- Coja un anueva aguja para cada inyección, use solo las agujas recomendadas en la sección “Agujas compatibles” en la última página de las instrucciones de uso.
- No use la aguja de la pluma si la lámina despegable está dañada o no está – deséchela y coja una nueva.
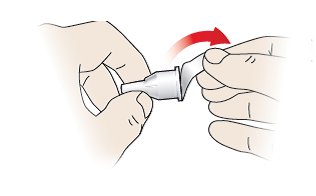
- Retire la lámina despegable (10).
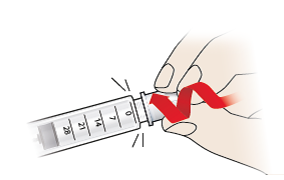
- Presione la aguja contra el extremo de la pluma y rósquela hasta que esté firmemente sujeta.
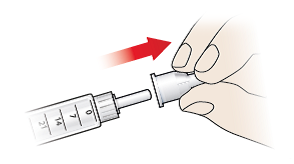
- Retire el capuchón exterior de la aguja (9) y guárdelo en un lugar seguro, ya que lo necesitará para retirar la aguja más tarde. Mantenga el protector interior de la aguja (8) en la aguja para evitar lesiones por pinchazos accidentales.
2. Inyección
2/a Establecimiento de dosis
Su pluma contiene 28 dosis fijadas de 80 microlitros. Esta dosis fija debe establecerse para cada inyección diaria.
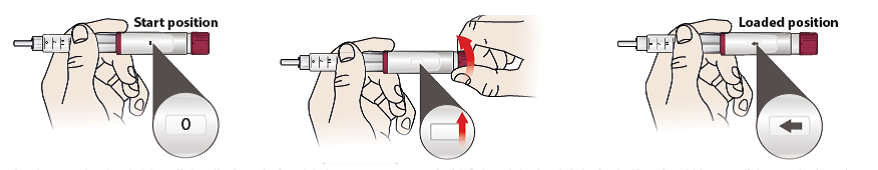
- Gire el botón de ajuste de dosis (6) hasta que el visor (5) muestre un símbolo de flecha y la perilla esté bloqueada. Debería escuchar un clic cuando la dosis esté correctamente configurada.
- El signo de la flecha significa que la dosis diaria fija está configurada y que la pluma está lista para la inyección.
- Si no puede ajustar la dosis, la pluma está casi vacía. Usa otra pluma.
2/b Elija el lugar de inyección
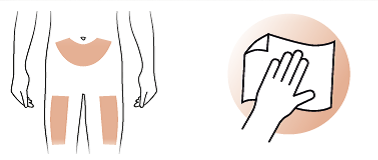
- Use su abdomen o la parte superior del muslo para la inyección. Prepare su piel según lo recomendado por su médico.
- Limpie la zona elegida con una toallita impregnada en alcohol.
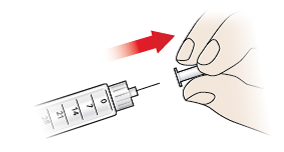
- Extraiga con cuidado el protector interior de la aguja (8) y deséchelo inmediatamente.
2/c Dispensación de dosis
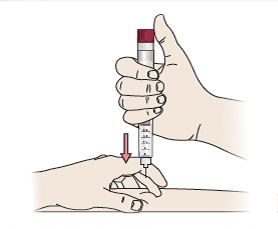
- Sujete suavemente un pliegue de la piel entre los dedos pulgar e índice. Introduzca la aguja recta y suavemente en la piel.
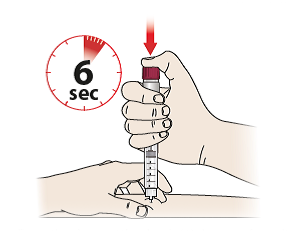
- Presiones el botón de ajuste de dosis (6) hasta el fondo y manténgalo presionado durante al menos 6 segundos para garantizar la administración de la dosis completa – Oirá un “click” cuando empiece a presionar el botón, es normal.
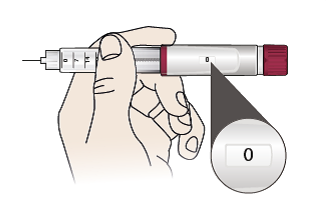
- Saque la pluma lentamente. Importante: Compruebe si la pantalla muestra ‘0’.
3. Después de la inyección
3/a Quitar la aguja
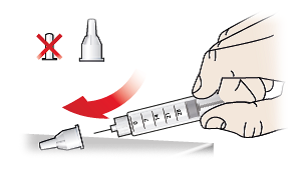
- Vuelva a colocar con cuidado el capuchón exterior de la aguja (9) tapando la aguja (7).
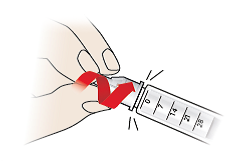
- Sujete el capuchón exterior de la aguja (9) y desenrosque la aguja (7).
- Deseche siempre las agujas de forma segura utilizando un contenedor para objetos punzantes o siguiendo las indicaciones de su médico.
3/b Cómo guardar la pluma
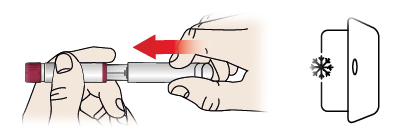
- Coloque de nuevo el capuchón (1) en la pluma.
- Vuelva a poner la pluma en la nevera entre 2 y 8 °C inmediatamente después de su uso.
3/c Cómo desechar la pluma

Cuando deseche la pluma después de 28 días de uso, hágalo con cuidao, y como se describe en la sección “Cómo desechar la pluma Terrosa y las agujas usadas” en la última página de estas Instrucciones de Uso.

Solución de problemas
Si tiene alguna pregunta con respecto al uso de la Terrosa Pen, siga las instrucciones que se dan en la tabla de la página siguiente:
| Problema | Solución |
| 1. Pequeñas burbujas de aire visibles en el cartucho. | Una pequeña burbuja de aire no afectará a la dosis ni causará daños. |
| 2. No puede colocarse la aguja. | Utilice otra aguja. Si la segunda aguja tampoco se puede colocar, contacte con con el servicio de atención al paciente. |
| 3. La aguja está rota/doblada/torcida. | Utilice otra aguja. |
| 4. Si accidentalmente intenta inyectar sin la aguja colocada. | Coloque la aguja. Observará la salida de algunas gotas. La pluma está de nuevo lista para su uso. Establezca la dosis e inyecte. |
| 5. El botón de ajuste de dosis no se puede girar hacia arriba hasta el signo de la flecha. | La cantidad de medicamento en la pluma Terrosa es menor a 80 microlitros. Utilice una nueva pluma Terrosa. |
| 6. Si la pantalla no vuelve a la posición ‘0’ después de la inyección. | No repita la inyección el mismo día. Use una nueva aguja para la inyección al día siguieete. Si la pantalla aún no regresa a la posición ‘0’ después de la inyección, no use esta pluma; póngase en contacto con el servicio de atención al paciente. |
| 7. La pluma tiene pérdidas. | No use esta pluma; contacte con el servicio de atención al paciente. |
Información adicional importante
- La pluma Terrosa precargada contiene 28 dosis diarias fijas de 80 microlitros de solución inyectable Terrosa solution para el tratamiento de la osteoporosis.
- No transfiera el medicamento a una jeringa.
- Utilice la pluma Terrosa únicamente como le haya indicado su médico y según la información de estas Instrucciones de Uso y del prospecto de Terrosa
- Use una nueva aguja para cada inyección.
- La pluma Terrosa puede ser utilizada por los propios pacientes mayores de 18 años, profesionales sanitarios o terceros como, por ejemplo, familiares adultos.
- La pluma Terrosa no debe ser utilizada por pacientes ciegos o con discapacidad visual sin la ayuda de una persona entrenada y sin discapacidad. Consulte a su médico en caso de tener problemas de audición o manipulación.
Si tiene alguna duda en relación con el uso de la pluma Terrosa, por favor, contacte con el servicio de atención al paciente.
Teléfono: XXXXXXXXXX
Email: XXXXXXXX
Agujas compatibles
- Aguja Clickfine de calibre 29 a 31 (diámetro 0,25 – 0,33 mm) y longiturd de 12, 10, 8 o 6 mm.
- Aguja BD Micro-Fine de calibre 29 a 31 (diámetro 0,25 – 0,33 mm) y longitud 12,7, 8 o 5 mm.
Almacenamiento y cuidado de la pluma Terrosa
- No guarde la pluma Terrosa con la aguja colocada ya que puede causar la formación de burbujas de aire in el cartucho.
- Transporte y guarde la pluma Terrosa a temperaturas entre 2 y 8 °C.
- No guarde la pluma Terrosa en el congelador. Si el medicamento se ha congelado, deseche el dispositivo y use una nueva pluma Terrosa.
- Guarde la pluma Terrosa y las agujas fuera del alcance de los niños.
- Manipule la pluma con cuidado. No deje caer la pluma y evite golpearla contra superficies duras. Protéjala del agua, el polvo y la humedad.
- Puede utilizar un paño húmedo para limpiar la pluma Terrosa. No utilice alcohol, disolventes o agentes de limpieza. No sumerja la pluma Terrosa en agua, ya que podría dañarla.
- No utilice la pluma Terrosa si está dañada o si tiene dudas sobre su correcto funcionamiento.
Cómo desechar la pluma Terrosa y las agujas usadas
- Deseche la pluma Terrosa pasados 28 días del primer uso.
- Antes de desechar la pluma Terrosa quite siempre la aguja.
- Ponga las agujas usadas in un contenedor para objetos punzantes o en un envase de plástico duro con tapa de seguridad. No tire las agujas directamente a la basura doméstica.
- No recicle el contenedor de objetos punzantes lleno.
- Pregunte a su médico o farmacéutico sobre las distintas opciones para desechar adecuadamente la pluma y el contenedor de objetos punzantes.
- Las instrucciones relativas a la manipulación de las agujas no pretenden sustituir las políticas locales, de los profesionales sanitarios o de las instituciones.
Titular de la autorización de comercialización: Gedeon Richter Plc., Hungría
Fabricado por Gedeon Richter Plc., Hungría
Este manual de usuario fue revisado por última vez en


