Video
Packungsbeilage
Gebrauchsinformation: Information für Anwender
Terrosa 20 Mikrogramm/80 Mikroliter Injektionslösung im Fertigpen
Teriparatid
Lesen Sie die gesamte Packungsbeilage sorgfältig durch, bevor Sie mit der Anwendung dieses Arzneimittels beginnen, denn sie enthält wichtige Informationen.
- Heben Sie die Packungsbeilage auf. Vielleicht möchten Sie diese später nochmals lesen.
- Wenn Sie weitere Fragen haben, wenden Sie sich an Ihren Arzt oder Apotheker.
- Dieses Arzneimittel wurde Ihnen persönlich verschrieben. Geben Sie es nicht an Dritte weiter. Es kann anderen Menschen schaden, auch wenn diese die gleichen Beschwerden haben wie Sie.
- Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Siehe Abschnitt 4.
Was in dieser Packungsbeilage steht
- Was ist Terrosa und wofür wird es angewendet?
- Was sollten Sie vor der Anwendung von Terrosa beachten?
- Wie ist Terrosa anzuwenden?
- Welche Nebenwirkungen sind möglich?
- Wie ist Terrosa aufzubewahren?
- Inhalt der Packung und weitere Informationen
1. Was ist Terrosa und wofür wird es angewendet?
Terrosa enthält als Wirkstoff Teriparatid. Dieser wird verwendet, um die Knochen zu festigen und das Risiko von Knochenbrüchen zu senken, indem er den Knochenaufbau anregt.
Terrosa wird bei Erwachsenen zur Osteoporose-Behandlung eingesetzt. Osteoporose ist eine Erkrankung, durch die Ihre Knochen dünn und brüchig werden. Diese Erkrankung tritt bei Frauen nach den Wechseljahren (Menopause) besonders häufig auf, kann aber auch bei Männern auftreten. Eine Osteoporose tritt auch häufig bei Patienten auf, die Arzneimittel erhalten, welche als Corticosteroide bezeichnet werden.
2. Was sollten Sie vor der Anwendung von Terrosa beachten?
Terrosa darf nicht angewendet werden,
- wenn Sie allergisch gegen Teriparatid oder einen der in Abschnitt 6. genannten sonstigen Bestandteile dieses Arzneimittels sind.
- wenn Sie erhöhte Calcium‑Spiegel im Blut haben (vorbestehende Hyperkalzämie).
- wenn Sie eine schwere Nierenerkrankung haben.
- wenn Sie jemals Knochenkrebs oder eine andere Krebsart hatten, die Ihre Knochen befallen hat (metastasiert ist).
- wenn Sie bestimmte Knochenerkrankungen haben. Teilen Sie Ihrem Arzt mit, wenn Sie (außer der Osteoporose) eine Knochenerkrankung haben.
- wenn Sie hohe Blutspiegel des Enzyms namens Alkalische Phosphatase haben und die Ursache dafür nicht geklärt ist; dies könnte bedeuten, dass Sie die Paget‑Krankheit des Knochens (eine Erkrankung mit erhöhtem Knochenumbau) haben. Fragen Sie Ihren Arzt, wenn Sie sich nicht sicher sind.
- wenn Sie eine Strahlenbehandlung hatten, bei der Ihr Skelett im Strahlenfeld lag.
- wenn Sie schwanger sind oder stillen.
Warnhinweise und Vorsichtsmaßnahmen
Terrosa kann das Calcium in Ihrem Blut oder Ihrem Urin erhöhen.
Bitte sprechen Sie mit Ihrem Arzt, bevor oder wenn Sie Terrosa anwenden:
- wenn Sie unter andauernder Übelkeit, Erbrechen, Verstopfung, Energielosigkeit oder Muskelschwäche leiden. Dies können Anzeichen eines erhöhten Calcium‑Blutspiegels sein.
- wenn Sie Nierensteine haben oder in der Vergangenheit hatten.
- wenn bei Ihnen eine Nierenerkrankung bekannt ist (eine mittelschwere Einschränkung der Nierenfunktion vorliegt).
Manchen Patienten wird nach den ersten Terrosa‑Dosen schwindlig oder sie bekommen einen schnelleren Herzschlag. Injizieren Sie sich daher Terrosa die ersten Male an einem Ort, wo Sie sich direkt hinsetzen oder hinlegen können, wenn Ihnen schwindlig wird.
Die empfohlene Therapiedauer von 24 Monaten sollte nicht überschritten werden.
Bevor Sie mit der Anwendung eines neuen Fertigpens beginnen, notieren Sie die Chargennummer (Lot) des Arzneimittels und das Datum der ersten Injektion auf dem Umkarton des Fertigpens und in einem Kalender und nennen diese Information, wenn Sie Nebenwirkungen melden.
Terrosa darf nicht bei jungen Erwachsenen, die sich noch in der Wachstumsphase befinden, angewendet werden.
Kinder und Jugendliche
Terrosa darf nicht bei Kindern und Jugendlichen (unter 18 Jahren) angewendet werden.
Anwendung von Terrosa zusammen mit anderen Arzneimitteln
Informieren Sie Ihren Arzt oder Apotheker, wenn Sie andere Arzneimittel anwenden, kürzlich andere Arzneimittel angewendet haben oder beabsichtigen, andere Arzneimittel anzuwenden.
Dies ist wichtig, weil bestimmte Arzneimittel (z. B. Digoxin/Digitalis, ein Arzneimittel zur Behandlung von Herzerkrankungen) Wechselwirkungen mit Teriparatid haben können.
Schwangerschaft und Stillzeit
Wenden Sie Terrosa nicht an, wenn Sie schwanger sind oder stillen. Wenn Sie eine Frau im gebärfähigen Alter sind, müssen Sie während der Behandlung mit Terrosa zuverlässige Verhütungsmethoden anwenden. Wenn Sie schwanger werden, während Sie Terrosa anwenden, muss Terrosa abgesetzt werden. Fragen Sie vor der Einnahme dieses Arzneimittels Ihren Arzt oder Apotheker um Rat.
Verkehrstüchtigkeit und Fähigkeit zum Bedienen von Maschinen
Manche Patienten können sich nach einer Terrosa‑Injektion schwindlig fühlen. Sollten Sie sich schwindlig fühlen, dürfen Sie nicht aktiv am Straßenverkehr teilnehmen oder Maschinen bedienen, bis es Ihnen wieder besser geht.
Terrosa enthält Natrium
Dieses Arzneimittel enthält weniger als 1 mmol Natrium (23 mg) pro Dosis, d. h. es ist nahezu „natriumfrei“.
3. Wie ist Terrosa anzuwenden?
Wenden Sie dieses Arzneimittel immer genau nach Absprache mit Ihrem Arzt an. Fragen Sie bei Ihrem Arzt oder Apotheker nach, wenn Sie sich nicht sicher sind.
Die empfohlene Dosis beträgt 20 Mikrogramm (entsprechend 80 Mikroliter), die einmal täglich durch die Injektion unter die Haut des Unterbauchs oder des Oberschenkels verabreicht wird (subkutane Injektion).
Um es Ihnen zu erleichtern, an die nächste Injektion Ihres Arzneimittels zu denken, sollten Sie sich diese immer um dieselbe Tageszeit verabreichen. Terrosa kann zu den Mahlzeiten injiziert werden.
Wenden Sie Terrosa so lange einmal täglich an, wie es Ihr Arzt Ihnen verordnet hat. Die Gesamtbehandlungsdauer mit Terrosa darf 24 Monate nicht überschreiten. Sie sollten im Laufe Ihres Lebens nicht mehr als einen 24‑monatigen Behandlungszyklus erhalten.
Eventuell rät Ihnen Ihr Arzt, während der Behandlung mit Terrosa Calcium‑ und/oder Vitamin D‑Präparate einzunehmen. Ihr Arzt wird Ihnen sagen, wie viel Sie täglich davon einnehmen sollen.
Terrosa kann zu den Mahlzeiten oder unabhängig davon angewendet werden.
Die kompatiblen Injektionsnadeln liegen der Terrosa-Packung nicht bei.
Der Fertigpen kann mit Injektionsnadeln mit einer Stärke zwischen 29 G und 31 G (0,25 – 0,33 mm Durchmesser) und einer Länge zwischen 5 mm und 12,7 mm verwendet werden, die gemäß dem ISO-Standard für Pen-Nadeln ausschließlich für die subkutane Injektion entwickelt wurden.
Für den richtigen Gebrauch dieses Arzneimittels ist es sehr wichtig, die ausführliche Gebrauchsanweisung zu Ihrem Fertigpen genau zu befolgen, die dem Arzneimittel beigefügt ist.
Verwenden Sie für jede Injektion eine neue Nadel, um Verunreinigungen zu verhindern, und entsorgen Sie die Nadel nach der Anwendung sicher.
Bewahren Sie Ihren Fertigpen niemals mit aufgesetzter Nadel auf.
Füllen Sie das Arzneimittel nicht in eine Spritze um.
Sie sollten Terrosa injizieren, kurz nachdem Sie den Fertigpen aus dem Kühlschrank genommen haben. Stecken Sie die Kappe des Fertigpens auf den Fertigpen und legen Sie ihn direkt nach Gebrauch zurück in den Kühlschrank. Belassen Sie ihn während der gesamten 28‑tägigen Anwendungszeit im Kühlschrank.
Vorbereitung der Injektion
- Um sicherzugehen, dass Sie Terrosa richtig anwenden, lesen Sie bitte die im Umkarton des Arzneimittels befindliche Gebrauchsanweisung des Terrosa Fertigpens vollständig durch.
- Waschen Sie sich die Hände, bevor Sie den Fertigpen anfassen.
- Überprüfen Sie das Verfalldatum auf dem Etikett des Fertigpens, bevor Sie das Arzneimittel verwenden. Stellen Sie sicher, dass noch mindestens 28 Tage bis zum Verfalldatum verbleiben. Notieren Sie die Chargennummer (Lot) und das Datum der ersten Injektion aus diesem Fertigpen in einem Kalender. Das Datum der ersten Injektion sollte auch auf dem Umkarton der Terrosa‑Packung notiert werden (siehe frei gelassene Stelle auf dem Umkarton nach: {Erster Gebrauch:}).
- Befestigen Sie eine neue Injektionsnadel auf dem Fertigpen und stellen Sie die Dosis in der Dosisanzeige ein, indem Sie an dem Dosierknopf drehen.
Injektion von Terrosa
- Bevor Sie Terrosa spritzen, säubern Sie die für die Injektion vorgesehene Hautstelle (Oberschenkel oder Bauch), wie es Ihnen Ihr Arzt gezeigt hat.
- Greifen Sie behutsam eine Hautfalte des gesäuberten Hautbereichs und stechen Sie die Nadel gerade in die Haut. Drücken Sie den Dosierknopf und halten Sie ihn für mindestens sechs Sekunden gedrückt, um sicherzugehen, dass Sie die vollständige Dosis erhalten haben.
- Nachdem Sie die Injektion beendet haben, setzen Sie sofort die äußere Nadelschutzkappe auf die Injektionsnadel und schrauben die Nadelschutzkappe gegen den Uhrzeigersinn ab, sodass die Nadel entfernt wird. Damit bleibt das restliche Terrosa steril und der Fertigpen kann nicht undicht werden. Auch kann dadurch keine Luft zurück in den Fertigpen gelangen und die Nadel nicht verstopfen.
- Setzen Sie die Kappe des Fertigpens wieder auf den Fertigpen.
- Entsorgen Sie die Injektionsnadeln in einem durchstechsicheren Behälter oder wie von Ihrem Arzt empfohlen.
Wenn Sie eine größere Menge von Terrosa angewendet haben, als Sie sollten
Sollten Sie versehentlich mehr Terrosa als vorgesehen angewendet haben, setzen Sie sich mit Ihrem Arzt oder Apotheker in Verbindung.
Zu den nach einer Überdosierung zu erwartenden Symptomen zählen Übelkeit, Erbrechen, Schwindel und Kopfschmerzen.
Wenn Sie die Anwendung von Terrosa vergessen haben
Wenn Sie eine Injektion vergessen haben oder Ihr Arzneimittel nicht zur vorgesehenen Zeit anwenden können, holen Sie die Injektion möglichst bald am selben Tag nach. Wenden Sie nicht die doppelte Menge an, wenn Sie die vorherige Injektion vergessen haben. Geben Sie sich nicht mehr als eine Injektion täglich.
Wenn Sie die Anwendung von Terrosa abbrechen
Wenn Sie beabsichtigen, die Behandlung mit Terrosa abzubrechen, dann besprechen Sie dies mit Ihrem Arzt. Ihr Arzt wird Sie beraten und entscheiden, wie lange Sie mit Terrosa behandelt werden sollen.
Wenn Sie weitere Fragen zur Anwendung dieses Arzneimittels haben, wenden Sie sich an Ihren Arzt oder Apotheker.
4. Welche Nebenwirkungen sind möglich?
Wie alle Arzneimittel kann auch dieses Arzneimittel Nebenwirkungen haben, die aber nicht bei jedem auftreten müssen.
Die häufigsten Nebenwirkungen sind Gliederschmerzen (Häufigkeit: sehr häufig, kann mehr als 1 von 10 Behandelten betreffen). Zu weiteren häufigen Nebenwirkungen (können bis zu 1 von 10 Behandelten betreffen) zählen Übelkeit, Kopfschmerzen und Schwindel. Wenn Ihnen nach einer Injektion schwindlig wird (Benommenheit auftritt), sollten Sie sich hinsetzen oder hinlegen, bis Sie sich besser fühlen. Falls Sie sich doch nicht besser fühlen, sollten Sie einen Arzt aufsuchen, bevor Sie die Behandlung fortsetzen. Fälle von Ohnmacht sind nach Teriparatid‑Behandlung aufgetreten.
Wenn Beschwerden an der Einstichstelle, wie Hautrötungen, Schmerzen, Schwellungen, Juckreiz, Blutergüsse oder kleine Hautblutungen, bei Ihnen auftreten (kann häufig auftreten), sollten diese nach einigen Tagen oder Wochen verschwinden. Falls nicht, sprechen Sie mit Ihrem Arzt.
Selten (kann bis zu 1 von 1 000 Behandelten betreffen) können bei manchen Patienten allergische Reaktionen in Form von Atemnot, Gesichtsschwellungen, Ausschlag und Brustschmerzen auftreten. Diese Reaktionen treten zumeist kurz nach der Injektion auf. In seltenen Fällen können schwerwiegende und möglicherweise lebensbedrohliche allergische Reaktionen, einschließlich Anaphylaxie, auftreten.
Weitere mögliche Nebenwirkungen:
Häufig (kann bis zu 1 von 10 Behandelten betreffen)
- Erhöhung des Cholesterinspiegels
- Depression
- Nervenschmerzen in den Beinen
- Schwächegefühl
- Drehschwindel
- Herzrhythmusstörungen
- Atemnot
- vermehrtes Schwitzen
- Muskelkrämpfe
- Energiemangel
- Müdigkeit
- Schmerzen im Brustbereich
- niedriger Blutdruck
- Sodbrennen (Schmerzen oder Brennen unterhalb des Brustbeins)
- Erbrechen
- Zwerchfellbruch (Hiatushernie)
- niedriges Hämoglobin oder niedrige Anzahl der roten Blutzellen (Anämie)
Gelegentlich (kann bis zu 1 von 100 Behandelten betreffen)
- erhöhter Puls
- veränderte Herzgeräusche
- Kurzatmigkeit
- Hämorrhoiden
- Harninkontinenz
- Harndrang
- Gewichtszunahme
- Nierensteine
- Muskel‑ und Gelenkschmerzen. Einige Patienten hatten schwere Rückenkrämpfe oder ‑schmerzen, die zur Krankenhauseinweisung führten.
- Anstieg der Blut‑Calciumwerte
- Anstieg der Blut‑Harnsäurewerte
- Anstieg eines Enzyms, das Alkalische Phosphatase genannt wird
Selten (kann bis zu 1 von 1 000 Behandelten betreffen)
- Fälle von verringerter Nierenfunktion einschließlich Nierenversagen
- Schwellungen, hauptsächlich an den Händen, Füßen und Beinen
Meldung von Nebenwirkungen
Wenn Sie Nebenwirkungen bemerken, wenden Sie sich an Ihren Arzt oder Apotheker. Dies gilt auch für Nebenwirkungen, die nicht in dieser Packungsbeilage angegeben sind. Sie können Nebenwirkungen auch direkt über das in Anhang V aufgeführte nationale Meldesystem anzeigen. Indem Sie Nebenwirkungen melden, können Sie dazu beitragen, dass mehr Informationen über die Sicherheit dieses Arzneimittels zur Verfügung gestellt werden.
5. Wie ist Terrosa aufzubewahren?
Bewahren Sie dieses Arzneimittel für Kinder unzugänglich auf.
Sie dürfen dieses Arzneimittel nach dem auf dem Etikett nach „EXP“ und dem Umkarton nach „verwendbar bis“ angegebenen Verfalldatum nicht mehr verwenden. Das Verfalldatum bezieht sich auf den letzten Tag des angegebenen Monats.
Immer im Kühlschrank lagern (2 °C ‑ 8 °C). Der Fertigpen muss nach der Anwendung sofort in den Kühlschrank zurückgelegt werden. Nicht einfrieren.
Die Kappe des Fertigpens auf dem Fertigpen lassen, um den Inhalt vor Licht zu schützen.
Sie können Terrosa bis zu 28 Tage nach Anbruch verwenden, vorausgesetzt, der Fertigpen wird im Kühlschrank (2 °C ‑ 8 °C) gelagert.
Vermeiden Sie es, den Fertigpen nahe am Gefrierfach des Kühlschranks zu lagern, um ein Einfrieren zu verhindern. Wenden Sie Terrosa nicht an, wenn es eingefroren ist oder war.
Jeder Fertigpen muss 28 Tage nach seinem ersten Gebrauch ordnungsgemäß entsorgt werden, auch wenn er noch nicht völlig leer ist.
Terrosa enthält eine klare und farblose Lösung. Benutzen Sie Terrosa nicht, wenn sich sichtbare Teilchen gebildet haben oder die Lösung wolkig oder verfärbt ist.
Entsorgen Sie Arzneimittel nicht im Abwasser oder Haushaltsabfall. Fragen Sie Ihren Apotheker, wie das Arzneimittel zu entsorgen ist, wenn Sie es nicht mehr verwenden. Sie tragen damit zum Schutz der Umwelt bei.
6. Inhalt der Packung und weitere Informationen
Was Terrosa enthält
- Der Wirkstoff ist Teriparatid. Jede Dosis zu 80 Mikroliter enthält 20 Mikrogramm Teriparatid. Ein Fertigpen mit 2,4 ml enthält 600 Mikrogramm Teriparatid (entsprechend 250 Mikrogramm pro ml).
- Die sonstigen Bestandteile sind: Essigsäure 99 %, Mannitol, Metacresol, Natriumacetat‑Trihydrat, Salzsäure (zur pH‑Wert‑Einstellung), Natriumhydroxid (zur pH‑Wert‑Einstellung) und Wasser für Injektionszwecke (siehe Abschnitt 2. „Terrosa enthält Natrium“).
Wie Terrosa aussieht und Inhalt der Packung
Terrosa ist eine farblose und klare Lösung zur Injektion (Injektion). Es ist in einem Fertigpen abgefüllt. Jeder Fertigpen enthält 2,4 ml Lösung, die für 28 Dosen ausreichen.
Packungsgrößen: 1 Fertigpen oder 3 Fertigpens in einem Umkarton.
Es werden möglicherweise nicht alle Packungsgrößen in den Verkehr gebracht.
Pharmazeutischer Unternehmer und Hersteller
Gedeon Richter Plc.
Gyömrői út 19-21.
1103 Budapest
Ungarn
Diese Packungsbeilage wurde zuletzt überarbeitet im
Weitere Informationsquellen Ausführliche Informationen zu diesem Arzneimittel erhalten Sie auch, wenn Sie den unten stehenden bzw. auf dem Umkarton befindlichen QR-Code mit einem Smartphone scannen. Dieselben Informationen sind auch unter folgendem URL abrufbar: www.terrosapatient.com

Ausführliche Informationen zu diesem Arzneimittel sind auf den Internetseiten der Europäischen Arzneimittel-Agentur http://www.ema.europa.eu/ verfügbar.
Gebrauchsanweisung
Terrosa 20 Mikrogramm/80 Mikroliter Injektionslösung im Fertigpen
Gebrauchsanweisung
Wichtige Information
Der Terrosa Fertigpen wird zur Abgabe einer täglichen voreingestellten Dosis von 80 Mikrolitern Terrosa Injektionslösung zur Behandlung von Osteoporose verwendet.
Ihr Fertigpen enthält 28 Dosen.
Es ist nicht möglich, eine andere Dosis als 80 Mikroliter einzustellen.
Wenn Sie die Dosis von 80 Mikrolitern nicht einstellen können, ist Ihr Fertigpen fast leer.
Der Terrosa Fertigpen kann nicht wiederbefüllt werden, verwenden Sie ihn nach der Abgabe von 28 Dosen nicht weiter.
Bauteile
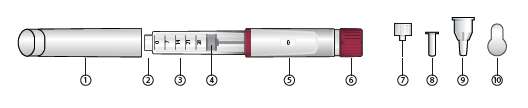
1. Kappe des Fertigpens
2. Nadelanschluss
3. Patronenhalterung
4. Stopfen
5. Dosisanzeige
6. Dosierknopf
7. Injektionsnadel
8. innere Nadelschutzkappe
9. äußere Nadelschutzkappe
10. abziehbare Schutzfolie
Injektionsnadeln liegen der Verpackung des Fertigpens nicht bei. Vor Gebrauch muss eine Injektionsnadel aufgesteckt werden (siehe Schritt 1/c).
Bevor Sie beginnen
Bevor Sie mit dem Gebrauch Ihres neuen Terrosa Fertigpens beginnen, lesen Sie diese Anleitung vollständig durch. Befolgen Sie die Anweisungen sorgfältig, wenn Sie den Fertigpen verwenden. Lesen Sie auch die ebenfalls enthaltene Gebrauchsinformation.
Notieren Sie das Datum der ersten Injektion in einem Kalender.
Teilen Sie Ihren Fertigpen oder Ihre Nadeln nicht mit anderen, da dies das Risiko birgt, sich mit ansteckenden Krankheiten zu infizieren.
Waschen Sie sich vor jeder Injektion die Hände.
Verwenden Sie Ihren Terrosa Fertigpen nicht, wenn er beschädigt ist oder wenn Sie Zweifel haben, dass er richtig funktioniert.
Legen Sie alles, was Sie benötigen, bereit:
• Alkoholtupfer
• Fertigpen
• Injektionsnadel
1. Vorbereitung Ihres Fertigpens
1/a Entfernen Sie die Kappe des Fertigpens (1), indem Sie sie abziehen.
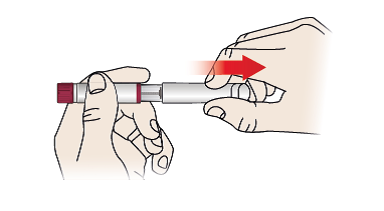
- Entfernen Sie die Kappe des Fertigpens (1), indem Sie sie abziehen.
1/b Überprüfen Sie das Arzneimittel
- Überprüfen Sie das Etikett des Terrosa Fertigpens, um sicherzugehen, dass Sie das richtige Arzneimittel haben und dass das Verfalldatum noch nicht abgelaufen ist.
- Verwenden Sie Ihren Terrosa Fertigpen nicht, wenn:
- der Fertigpen beschädigt ist
- die Lösung trüb oder verfärbt ist oder Partikel enthält.
1/c Befestigen Sie die Injektionsnadel
- Verwenden Sie für jede Injektion eine neue Injektionsnadel, und verwenden Sie ausschließlich Injektionsnadeln, die im Abschnitt „Kompatible Injektionsnadeln“ auf der Rückseite dieser Gebrauchsanweisung empfohlen werden.
- Verwenden Sie die Injektionsnadel nicht, wenn die abziehbare Schutzfolie beschädigt oder abgelöst ist – werfen Sie sie weg und nehmen Sie eine neue Injektionsnadel.
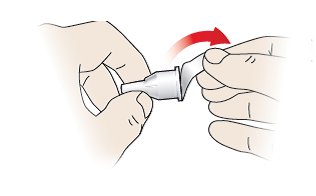
- Entfernen Sie die abziehbare Schutzfolie (10).
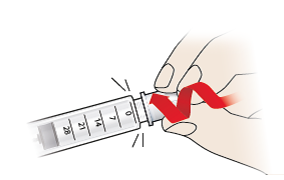
- Drücken Sie die Injektionsnadel auf die Spitze des Fertigpens und schrauben Sie sie auf, bis sie fest ist.
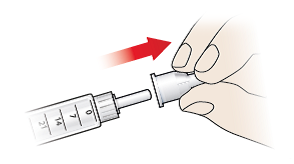
- Ziehen Sie die äußere Nadelschutzkappe (9) ab und bewahren Sie sie auf, da Sie sie später noch zum Entfernen der Injektionsnadel benötigen. Lassen Sie die innere Nadelschutzkappe (8) noch auf der Injektionsnadel, um versehentliche Stichverletzungen zu vermeiden.
2. Injektion
2/a Einstellen der Dosis
Ihr Fertigpen enthält 28 Fixdosen zu 80 Mikrolitern. Diese Dosis muss für die tägliche Injektion eingestellt werden.
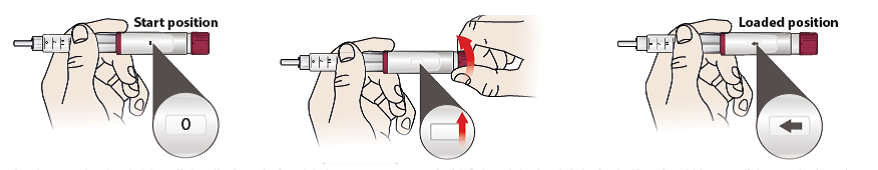
- Drehen Sie den Dosierknopf (6), bis ein Pfeilsymbol im Dosierfenster erscheint und der Knopf einrastet – Sie sollten ein Klickgeräusch hören, wenn die Dosis richtig eingestellt ist.
- Das Pfeilsymbol bedeutet, dass die tägliche Dosis eingestellt und der Fertigpen bereit für die Injektion ist.
- Falls Sie die Dosis nicht richtig einstellen können, ist der Fertigpen fast leer. Verwenden Sie einen anderen Fertigpen.
2/b Wählen Sie eine Injektionsstelle aus
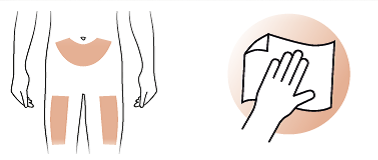
- Wählen Sie eine Stelle am Bauch oder Oberschenkel für die Injektion. Bereiten Sie Ihre Haut wie von Ihrem Arzt empfohlen vor.
- Reinigen Sie die ausgewählte Stelle mit einem Alkoholtupfer.
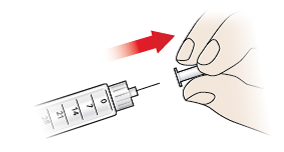
- Ziehen Sie die innere Nadelschutzkappe (8) vorsichtig ab und entsorgen Sie sie sofort.
2/c Abgabe der Dosis
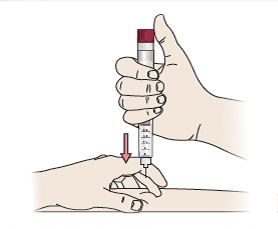
- Greifen Sie behutsam eine Hautfalte zwischen Daumen und Zeigefinger. Stechen Sie die Nadel gerade und vorsichtig in die Haut.
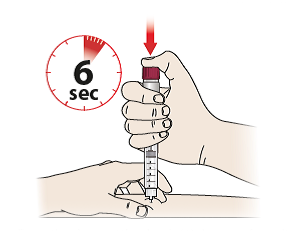
- Drücken Sie den Dosierknopf (6) so weit wie möglich hinein und halten Sie ihn für mindestens 6 Sekunden gedrückt, um sicherzustellen, dass die gesamte Dosis verabreicht wird – Sie werden ein Klicken hören, wenn Sie den Knopf drücken, dies ist normal.
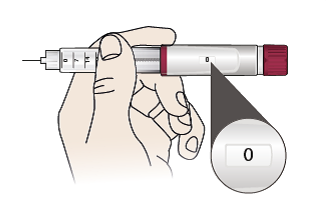
- Ziehen Sie den Fertigpen vorsichtig heraus. Wichtig: Überprüfen Sie, ob die Anzeige auf „0“ steht.
3. Nach der Injektion
3/a Entfernen Sie die Nadel
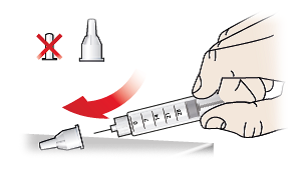
- Stecken Sie die äußere Nadelschutzkappe (9) vorsichtig wieder auf die Injektionsnadel (7).
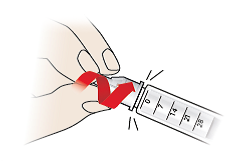
- Greifen Sie die äußere Nadelschutzkappe (9) und schrauben Sie die Injektionsnadel (7) ab.
- Entsorgen Sie Injektionsnadeln immer auf eine sichere Art und Weise, indem Sie einen durchstechsicheren Behälter verwenden, oder wie von Ihrem Arzt empfohlen.
3/b Aufbewahrung Ihres Fertigpens
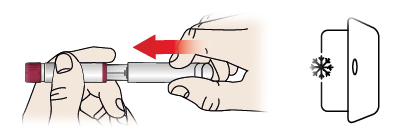
- Setzen Sie die Kappe des Pens (1) wieder auf den Fertigpen.
- Legen Sie den Fertigpen sofort nach dem Gebrauch zurück in den Kühlschrank (zwischen 2 °C und 8 °C).
3/c Entsorgung des Fertigpens

Wenn Sie Ihren Fertigpen nach 28 Tagen entsorgen müssen, tun Sie dies sorgfältig und so, wie im Abschnitt „Entsorgung des Terrosa Fertigpens und der verwendeten Injektionsnadeln“ auf der Rückseite dieser Gebrauchsanweisung beschrieben.

Fehlersuche
Folgen Sie den Anweisungen in der Tabelle, wenn Sie Fragen zur Anwendung des Terrosa Fertigpens haben.
| Problem | Lösung |
| 1. In der Patrone sind kleine Luftblasen zu sehen. | Eine kleine Luftblase wird die Dosis nicht beeinträchtigen oder Schäden verursachen. |
| 2. Die Nadel kann nicht aufgesteckt werden. | Verwenden Sie stattdessen eine andere Nadel. Wenn auch eine zweite Nadel nicht aufgesteckt werden kann, kontaktieren Sie den Kundendienst. |
| 3. Die Nadel ist abgebrochen/verbogen/geknickt. | Verwenden Sie stattdessen eine andere Nadel. |
| 4. Versehentlich wurde eine Injektion ohne aufgesetzte Nadel versucht. | Setzen Sie eine Nadel auf. Sie werden bemerken, dass ein paar Tropfen austreten. Der Fertigpen ist nun wieder einsatzbereit. Stellen Sie die Dosis ein und führen Sie die Injektion durch. |
| 5. Der Dosierknopf kann nicht bis zum Pfeilsymbol gedreht werden. | Die Menge an Arzneimittel, die noch im Terrosa Fertigpen ist, beträgt weniger als 80 Mikroliter. Verwenden Sie einen neuen Terrosa Fertigpen. |
| 6. Die Dosisanzeige kehrt nach der Injektion nicht wieder auf „0“ zurück. | Wiederholen Sie die Injektion nicht am gleichen Tag. Verwenden Sie am nächsten Tag eine neue Nadel für Ihre Injektion. Wenn die Anzeige nach der Injektion noch immer nicht auf „0“ zurückkehrt, verwenden Sie diesen Pen nicht mehr; kontaktieren Sie den Kundendienst. |
| 7. Der Pen verliert Flüssigkeit. | Verwenden Sie diesen Pen nicht; kontaktieren Sie den Kundendienst. |
Weitere wichtige Informationen
- Der befüllte Terrosa Fertigpen enthält 28 tägliche Fixdosen zu 80 Mikrolitern Terrosa Injektionslösung zur Behandlung von Osteoporose.
- Füllen Sie das Arzneimittel nicht in eine Spritze um.
- Verwenden Sie Ihren Terrosa Fertigpen nur wie von Ihrem Arzt verordnet, gemäß dieser Gebrauchsanweisung und der Terrosa Gebrauchsinformation.
- Nehmen Sie für jede Injektion eine neue Nadel.
- Der Terrosa Fertigpen kann zur Selbstverabreichung von Patienten über 18 Jahren, von medizinischem Fachpersonal und von Dritten wie beispielsweise erwachsenen Angehörigen verwendet werden.
- Der Terrosa Fertigpen darf nicht von blinden oder sehbehinderten Patienten ohne die Hilfe einer geschulten Person ohne entsprechende Behinderung angewendet werden. Fragen Sie Ihren Arzt, wenn Sie eingeschränktes Hörvermögen oder Probleme mit der Anwendung haben.
Wenn Sie Fragen zur Anwendung des Terrosa Fertigpens haben, kontaktieren Sie unseren Kundendienst.
Telefonnummer:
E-Mail:
Kompatible Injektionsnadeln
- Mylife™ Clickfine® 29 G bis 31 G (0,25 – 0,33 mm Durchmesser) und 12, 10, 8 oder 6 mm Länge
- BD Micro-Fine Ultra™ 29G bis 31G (0,25 – 0,33 mm Durchmesser) und 12,7 mm, 8 mm oder 5 mm Länge
Aufbewahrung und Pflege des Terrosa Fertigpens
- Lagern Sie Ihren Terrosa Pen nicht mit aufgesetzter Nadel, da sich hierdurch Luftblasen in der Patrone bilden können.
- Transportieren und lagern Sie den Terrosa Fertigpen bei Temperaturen zwischen 2 °C und 8 °C.
- Lagern Sie Ihren Terrosa Fertigpen nicht im Gefrierfach. Wenn das Arzneimittel eingefroren war, entsorgen Sie das Gerät und verwenden Sie einen neuen Terrosa Fertigpen.
- Bewahren Sie Ihren Terrosa Fertigpen und die Injektionsnadeln für Kinder unzugänglich auf.
- Gehen Sie sorgfältig mit Ihrem Pen um. Lassen Sie ihn nicht fallen und vermeiden Sie es, ihn an harte Oberflächen zu stoßen. Schützen Sie ihn vor Wasser, Staub und Feuchtigkeit.
- Zur Reinigung des Terrosa Fertigpens ist ein feuchtes Tuch ausreichend. Verwenden Sie keinen Alkohol, andere Lösungs- oder Reinigungsmittel. Tauchen Sie Ihren Terrosa Fertigpen niemals in Wasser, da dies den Fertigpen beschädigen kann.
- Verwenden Sie Ihren Terrosa Fertigpen nicht, wenn er beschädigt ist oder wenn Sie Zweifel haben, ob er richtig funktioniert.
Entsorgung des Terrosa Fertigpens und der verwendeten Injektionsnadeln
- Entsorgen Sie Ihren Terrosa Fertigpen 28 Tage nach dem ersten Gebrauch.
- Entfernen Sie vor der Entsorgung des Terrosa Fertigpens immer die Injektionsnadel.
- Entsorgen Sie die gebrauchten Nadeln immer in einem durchstechsicheren Behälter oder in einem Hartplastikbehälter mit einem sicher schließendem Deckel. Entsorgen Sie die Injektionsnadeln nicht direkt im Hausmüll.
- Führen Sie den gefüllten durchstechsicheren Behälter nicht dem Recycling-System zu.
- Fragen Sie Ihren Arzt oder Apotheker zu den Möglichkeiten zur richtigen Entsorgung des Fertigpens und des durchstechsicheren Behälters.
- Die Anweisungen zum Umgang mit den Injektionsnadeln ersetzen nicht die örtlichen, medizinischen oder einrichtungsbezogenen Bestimmungen.
Zulassungsinhaber: Gedeon Richter Plc., Ungarn
Hersteller: Gedeon Richter Plc., Ungarn
Diese Gebrauchsanweisung wurde zuletzt überarbeitet im


